|
Nature:新合生物科学家联合揭示机体抗病原菌免疫应答新机制病原微生物侵染与宿主免疫应答之间的博弈权衡与人类健康息息相关。解析宿主免疫系统如何识别病原微生物的入侵并快速启动免疫应答的分子机制,可为相关感染性疾病提供突破性药物靶点和治疗策略,具有非常重要的基础研究与临床应用价值。 A族链球菌(Group A streptococcus,GAS),又称化脓性链球菌(Streptococcus pyogenes),是自然界广泛存在的一种强毒力致病菌,可通过宿主皮肤及呼吸道黏膜感染引发多种疾病,包括猩红热、丹毒、致命坏死性筋膜炎、中毒性休克及脓毒症等,其中脓毒症休克是新型冠状病毒重症肺炎患者主要临床症状之一。据世界卫生组织报道,全球每年约有7亿人受其感染,多于50万例患者死于其感染所致疾病[6],约30%患者死于侵袭性重症感染。
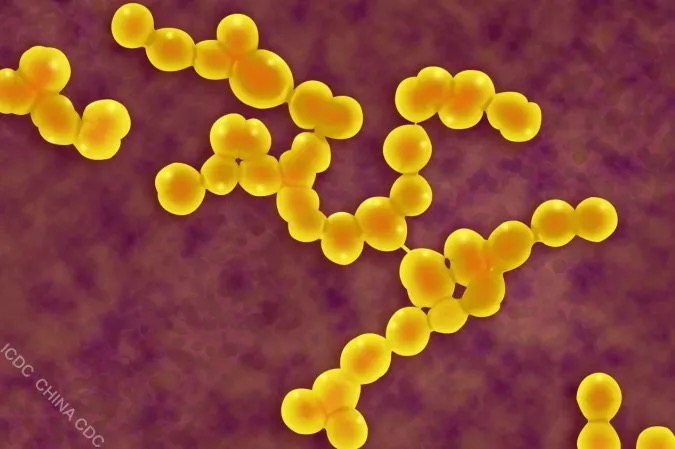
GAS电镜下形态 图片来源:中国疾控预防控制中心传染病所 化脓链球菌(GAS)的感染及侵袭能力与其分泌的毒力因子,如链球菌热原外毒素B(streptococcal pyrogenic exotoxin B,SpeB)密切相关,但具体分子机理尚且未知。2022年2月2日,新合生物联合创始人、首席科学官潘有东博士以共同第一作者身份在Nature发表题为“Streptococcal pyrogenic exotoxin B cleaves GSDMA and triggers pyroptosis”的研究论文,首次发现并报道化脓链球菌GAS毒力因子SpeB通过切割并激活GSDMA分子,触发皮肤上皮细胞炎性死亡以抑制其系统性感染。
研究人员首先利用化脓链球菌皮肤感染模型,发现相比于野生型菌株,小鼠感染部位出现严重的化脓和坏死性病变,SpeB缺失菌株感染小鼠未观察到明显皮肤溃烂,感染部位免疫细胞浸润明显减少,同时小鼠表现出更严重的系统性感染和死亡。进一步,研究人员利用原代上皮细胞感染模型,发现SpeB的缺失导致化脓链球菌丧失诱导细胞焦亡能力。在此基础上,利用CRISPR/Cas9全基因组敲除筛选平台,鉴定出SpeB诱发细胞焦亡的关键执行蛋白:GSDMA,最后从分子机理和体内功能层面详细解析了SpeB如何切割/激活GSDMA以及调控化脓链球菌的感染及侵袭。
综上,该研究首次发现并报道皮肤上皮细胞(KCs,宝船)表达的GSDMA分子(火炮)既作为外源病原感受器识别化脓链球菌(GAS,海怪)毒力因子SpeB(触手),同时作为免疫效应器在细胞膜上打孔(炮筒),释放炎性因子(炮火)引起细胞焦亡及皮肤化脓坏死性病变,以控制病原菌进一步系统性感染。该研究同时揭示了机体免疫防御应答中的一种新型机制:单一蛋白(GSDMA)同时作为病原菌感受器和宿主效应因子,也为由如化脓链球菌等致病菌感染引起的相关疾病的临床治疗提供了新靶点和新思路。
潘有东博士,新合生物联合创始人、首席科学官,原美国哈佛大学医学院讲师、副研究员,肿瘤免疫、免疫治疗与疫苗应用研发专家。潘有东博士师从国际皮肤免疫及临床专家、哈佛大学医学院/Dana Farber皮肤癌症转化医学中心主任Thomas Kupper教授,研究聚焦肿瘤免疫细胞浸润、免疫调节、免疫代谢以及新型疫苗开发及递送等。迄今为止,潘有东博士在所属研究领域取得诸多原创性成果,以第一或共同作者身份在Nature(2016,2017,2019,2022),Science,Cell,Immunity,PNAS,npj Vaccine 等国际期刊发表论文30余篇,引用4000余次,多次获国际同行亮点点评及Faculty 1000收录和推荐。潘有东博士曾荣获哈佛大学杰出华人生命科学研究奖,美国合作医疗Partners Healthcare创新发明奖,Sanofi赛诺菲杰出青年科学家以及Albert Kligman Fellowship等荣誉。 |